- TRSET
Baz örnekleri nelerdir? Baz maddeler nelerdir? Asidik ve bazik maddeler nelerdir?
Baz örnekleri formülleri. Bazik özellik gösteren maddeler. Baz Türleri. Kuvvetli ve zayıf bazlar.
Balsamik sirke baz mı? Asit mi? Makyaz bazları ne işe yarar? #Kimya #Baz #primer
+ index service
+ TR Search Engine Technology
baz kısaca anlatım.
Bazlarin kullanım alanları Bazlar hangi alanlarda kullanılır Baz hangi alanlarda kullanilir Bazların kullanım alanları Bazlarin kullanim alanlari Bazlarin kullaninm alnalaei bazlar nerelerde kullanilir Bazların özellikleri nelerdir? Bazların sanayide kullanım alanları Bazlar kullanım Bazıların kullanım alanını Baz kullanım alanları Bazlar ve bazların hayatımızdaki yeri. BAZ NEDİR Endüstride ve gündelik hayatta bazların kullanıldığı yerler. bazlatın kullanım alanları Bazların sanayideki yeri nedir? Günlük hayata baz lar Bazlar nerelerde kullanılır? Herkes için anlaşılabilir Kimya konuları. bazların genel özellikleri Baz ların kullanım alanları Baz olan maddeler bilgesellikFenolftalein Kopya kimya.
baz7, Akhne Bazlarin hayattaki önemlialanlari Asitler ve bAZLAR gunluk hayatta nasil kulanilir, Bazlarin hayattaki önemli alanlari Bazlar günlük hayattta kullandığımız alanlar Bazların özellikler , bazların günlük hayatta kullanımalanları , bazların kullanım alanLARI Asit ve baz Nedir 10 sınıf? Bazlar nedir örnek? Tuz ruhu asit mi baz mı? Yoğurt asit mi baz mı? Bazik yiyecekler nelerdir? Çamaşır suyu baz mı? Bazlar günlük hayatta nerelerde kullanılır? Baz olup olmadığını nasıl anlarız? Sirke suyu asit mi baz mı? Su asit mi baz mı? Limon suyu asit mi baz mı? pH kaç olursa asit olur? Maden suyu asit mi baz mı? Kekin kabarması asit mi baz mı? Portakal suyu asidik mi bazik mi? Zeytin yağı asit mi baz mı? Tuz ruhu içen ölür mü? Diş Macunu asit mi baz mı? Çay asit mi baz mı? Sigara asit mi baz mı? Idrar asit mi baz mı? Limonlu su alkali mi? Patates bazik mi? Günlük hayatta bazların kullanım alanları Kahve baz mı? Içme suyu baz mı? Süt baz mı? Hamur kabartma tozu asit mi baz mı? Coca Cola asit mi baz mı? Ayran asit mi baz mı? Sıvı sabun asit mi baz mı? Akü suyu asit mi baz mı? Baz neye etki eder? Kaç çeşit baz var? Sofra tuzu asit mi baz mı? Yağ çözücü asit mi baz mı? Bulaşık deterjanı asit mi baz mı? Yağmur suyu asit mi baz mı? Bazik su zararlı mı? Şampuan asit mi baz mı? Üzüm asit mi baz mı? Sirkenin pH değeri nedir? Gazoz baz mı? Kanımızın pH değeri nedir? En iyi pH kaç olmalı? Normal pH kaç? Kan şekeri asit mi baz mı? Meyve suları asit mi baz mı? Mide ilaçları asit mi baz mı? Kabartma tozu ve karbonat aynı şey mi? Asit ve baz karışırsa ne olur? Karbonatlı su asit mi baz mı? Acı biber suyu asit mi baz mı? Kolonya baz mı? Bal asit mi baz mı? Yoğurt asit mi baz mı? Ekmek asit mi baz mı? Ayçiçek yağı asit mi baz mı? Kezzap ve çamaşır suyu karışırsa ne olur? Kezzap içen ölür mü? Çamaşır suyu baz mı?bazların endüstride kullanımı
Bazların sanaiyde bazların günlük hayatta kullanım alanalrı. günlük hayatta kullanılan bazlar nekerdir. günlük hayatta kullanılan bazlar nelerdir? bazların günlük hayatta kullanım alanlarıBaz suda iyonlaştıklarında hidroksit iyonu derişimini arttıran maddeler yani suda iyonlaştıklarında ortama OH⁻ iyonu ve elektron çifti verebilen maddelere verilen isimdir. Bazlar da, asitler gibi tehlikeli maddelerdir.
Bazlar
Sulu çözeltilerinde hidroksit (OH–) iyonu bulunduran maddelere baz denir.
KOH → K+ + OH-
NaOH → Na+ + OH-
Ca (OH)2 → Ca++ + 2OH-
Bazı bazların sulu çözeltilerinde iyonlarına ayrışması yukarıdaki gibidir.
Bunların dışında kalan amonyak (NH3) hidroksit iyonu bulundurmamasına rağmen bazik özellik gösterir. Çünkü sulu çözeltisinde OH– iyonları oluşumuna sebep olur.
NH3 + H2O → NH4+ + OH–
Baz asidin karşıtıdır; fakat baz olmadan hiçbir asit tepkimesi gerçekleşemez. Bazların asitlerle tepkimeye girmesiyle tuzlar ve su oluşur ve bu duruma nötrleşme tepkimesi adı verilir. Çünkü tepkime ürünü olan tuz artık ne asit, ne de baz özelliği taşır, nötr bir bileşiktir.
Asit, kimyasal tepkime sırasında, her zaman, bir proton vermeye elverişliyse, baz da bu protonun alıcısıdır. Bir maddenin baz olabilmesi için protonu bağlayacak, her hangi bir kimyasal bağda kullanılmamış bir elektron çifti taşıması gerekmektedir. Fakat, yitirilecek protonu olduğu sürece asit olan madde, bu protonu yitirdiği an baza dönüşür. Protonunu yitiren asitte bir elektron çifti kalır.
Asit – baz tepkimesi kavramına, asit- baz çifti ya da aside eşlenik baz kavramı eklenir. Böylece asetik asit (CH3 – COOH), asetat iyonunu (CH3 – COO-) ya da eşlenik bazlarını karşılar.

Bazların Temel Özellikleri
Bazlar ele kayganlık hissi verir ve özellikle kuvvetli bazlar deri üzerinde yakıcı ve tahriş edici özelliğe sahiptir. Bazlar acı tattadır fakat tamamı için genelleme yapmak mümkün değildir. Bazı çeşit bazlar zehirlidir. Bu yüzden tadına bakmamak gerekir.
Bazlar da, asitler gibi turnusol kâğıdı ile ayırt edilebilir. – Bazlar kırmızı turnusol kâğıdını maviye dönüştürür. Bazlar fenolftalein çözeltisi yardımıyla da ayırt edilebilir. Baz içine fenolftalein’in alkoldeki çözeltisi damlatıldığında, baz pembe renk alır. Fenolftalein asit içine konulduğunda asitin rengini değiştirmez.
Fenolftalein soluk sarı renkli, toz halinde bir organik bileşiktir. Fenolftalein baz ortamda gül kırmızıya döner (pH > ~ 8.3)
Bazlar da asitler gibi suda iyonlarına ayrıştıkları için elektrik akımını iletirler.
En kuvvetli bazların başında NaOH ve KOH gelmektedir. Amonyak buharı göze, burna ve solunum yoluna ağır zarar vermektedir.
Bazların Yaşantımızdaki Kullanım Alanları
Sodyum hidroksit (NaOH) sabun yapımında kullanılır. Bu nedenle sabun ağza ve göze temas ettiğinde acı verir. Diş macunu ve şampuanlarda da baz mevcuttur ve acı tatları buradan gelmektedir.
Amonyak; sıvı deterjanların genelinde, yağ ve kireç sökücülerin yanı sıra diğer ev temizleyicilerinin de temel maddesidir.
Yemek sodası olarak bilinen kabartma tozu, bir çeşit baz olan sodyum bikarbonat (NaHCO3) içerir.
Yine kireç suyu bir çeşit bazdır. Aynı şekilde potasyum hidroksit (KOH) arap sabunu yapımında kullanılmaktadır.
Bazlar ve asitler tepkimeye girerek tuz ve su oluşturur. Baz + Asit → Tuz + Su

Bazlar ortamın pH ’ını yükseltir ve ester hidrolizi tepkimelerini sonuçlandırır.
Ester : hidroksil grubundaki hidrojen atomunun bir organik grup ile yer değiştirmesi sonucunda oluşan organik bileşiklerdir.
Genelde metaller bazlarla reaksiyon vermezler. Ancak amfoter metal olarak bilinen Al, Zn , Sn, Pb , Cr gibi metaller derişik kuvvetli baz çözeltileriyle reaksiyon verirler ve reaksiyon sonucunda hidrojen gazı açığa çıkar.
Amfoter metal + Baz → Tuz + hidrojen gazı
Al (k) + 3 NaOH (suda) → Na3 Al O3 + 3/2 H2 (g)
Zn (k) + 2 NaOH (suda) → Na2 Zn O2 + H2 (g)
Amfoter metallerin, oksit ve hidroksit bileşikleri de amfoter özellik göstermektedir. Bunların kuvvetli bazların derişik çözeltileri ile reaksiyonu sonucu tuz ve su çıkar.

Kuvvetli Bazlar
Kuvvetli elektrolitlerdir ve suda % 100 iyonlaşırlar. Deri ve gözlerde şiddetli travma / yıkım oluşturur.
Bazı kuvvetli bazları anımsayacak olursak:
NaOH = Sodyum Hidroksit
Sud kostik
Mg(OH)2 = Magnezyum hidroksit
Antasit
Lakzatif
Al(OH)3 = Aluminyum hidroksit
Antasit toksinleri, gazları absorbe ettiği için kabızlığa da sebebiyet vermektedir.
Metal hidroksit, kuvvetli bazların suda ayrışması
NaOH(s) → Na+(sulu) + OH- (sulu)
Mg(OH)2(s) → Mg2+ (sulu) + OH- (sulu)
Al(OH)3(s) → Al3+(sulu) + OH- (sulu)

Zayıf Bazlar
Suda iyonlaşma oranları düşük bazlardır.
NH3 = Amonyak bedende proteinlerin yıkımlanmasından gelebilir
CO32- antasitlerde
HCO3– antasitlerde ve tamponlarda
HPO42- tamponlarda
Zayıf elektrolitlerdir ve OH– içermezler, fakat H2O ile reaksiyon verirler. Az sayıda OH– oluştururlar.
Bazların su ile reaksiyon durumları aşağıdaki gibidir.
H2O
NH3(g) + H2O ⇔ NH4+ (sulu) + OH– (sulu)
HCO3– (sulu) + H2O ⇔ H2CO3 (sulu) + OH- (sulu)

Bazlar günlük hayatta nerde kullanılır ?
Günlük hayatta kullandığımız asit ve bazlar nerelerde kullanılır? Bazlara örnekler nelerdir? Bazlar günlük hayatta nerelerde kullanılır? Bazlara örnekler nelerdir? Baz hangi yiyeceklerde bulunur?
Bazların Kullanıldığı Yerler ve Formülleri
Sodyum hidroksit (NaOH) : Sabun, lavabo açıcı.
Potasyum hidroksit (KOH) : Arap sabunu, sıvı sabun, şampuan.
Kalsiyum hidroksit [ Ca (OH)2 ] : Sıva ve harç.
Alüminyum hidroksit [ Al (OH)3 ] : Deodorantlar.
Magnezyum hidroksit [ Mg (OH)2 ] : Antiasit.
Amonyak (NH3) : Ev temizlik malzemesi, gübre, patlayıcı madde.
Lityum Hidroksit ( LIOH ) : Pil, seramik, cam
Baryum Hidroksit [ Ba (OH)2 ] : İnşaat malzemeleri.
⇒ Bir maddenin ve/veya çözeltinin asit ya da baz olduğu formülden nasıl anlaşılır?
⇒ Asitler hakkında detaylı bilgi ister misiniz?
Baz Nedir?
Baz Nedir Biyoloji. Asit baz Nedir ? Günlük hayattan baz örnekleri
Baz Örnekleri
Sodyum hidroksit (NaOH) Kalsiyum hidroksit Ca (OH)2. Potasyum hidroksit (KOH) Magnezyum hidroksit Mg (OH)2. Baryum hidroksit Ba (OH)2. Amonyak (NH3)
Asit baz Tepkimeleri
Bazlar nelerdir örnek? Baz çeşitleri nelerdir? Baz nasıl gösterilir? NaOH asit mi baz mı?
Bazların Kullanım Alanları
Amonyaklı sıvı maddeler, yağ ve kireç sökücü olarak ev temizleyicilerinde kullanılır. Yemek sodası olarak bilinen kabartma tozu, bir çeşit baz olan sodyum bikarbonat içerir. Kireç suyu bir çeşit bazdır. Potasyum hidroksit, KOH Arap sabunu yapımında kullanılır.
Bazik özellik gösteren maddeler
Baz örnekleri formülleri. oh- iyonu nedir ? Bazik özellik gösteren maddeler. Asit baz Nedir? Asit baz Tepkimeleri. Baz Örnekleri.
Baz Nedir Biyoloji
Sulu çözeltilerinde tamamen iyonlaşan bazlar kuvvetli baz, sulu çözeltilerinde tamamen iyonlaşmayan bazlar ise zayıf baz adını alır. Potasyum hidroksit (KOH) ve sodyum hidroksit (NaOH) kuvvetli bazlara, yiyeceklerde bulunan bazlar zayıf bazlara örnektir. Asit ve baz örnekleri Asit Nedir
Baz nasıl gösterilir ?
Tamamen iyonlaşmayan asitlere ve bazlara zayıf asit veya baz denir. Zayıf asitler HA, zayıf bazlarda B ile gösterilir. NaOH asit mi baz mı? Sabun mi baz mı? KCl asit mi baz mı? Ekmek asit mi baz mı? Gazoz suyu asit mi baz mı? En güçlü baz nedir?
Ekmek asit mi baz mı?
Ekmek bazik bir yapıya sahiptir. Kakao işlenmemiş halinde acıdır ve bu da bazların ayırt edici bir özelliğidir. Etil alkol ne asit ne de bazdır, nötr özellikler gösterir.
Coca Cola asit mi baz mı?
Muz bazik mi? Diş Macunu asit mi baz mı? Süt baz mı? Limon suyu bazik mi? Türk kahvesi alkali mi? Göz yaşı baz mı? Brokoli bir baz mıdır? Pepsi kaç pH? Gargara baz mı? Vişne suyu asit mi baz mı? Turşu su asit mi baz mı?
Kabartma tozu baz mı? Kabartma tozunda yaygın kullanılan baz sodyum bikarbonattır. Karbonat olarak da bilinen bu bazın yanında kuru asit olarak bazı fosfat ve sülfat bileşikleri kullanılır.27 Nis 2015 Kabartma Tozu Nasıl Kabartır? - TÜBİTAK Bilim Genç https://bilimgenc.tubitak.gov.tr Kabartma tozu baz mı? Patates asit mi baz mı? Elma suyu asit mi baz mı? Deniz suyu asit mi? Mermer baz mı? Yumurta akı asit mi baz mi? Yağmur suyu asit mi baz mı? Akü suyu asit mi baz mı? Portakal suyu asit mi baz mı?
Bazlar nasıl ayırt edilir?
Günlük hayatta kullandığımız bazlar nelerdir? Ekmek asit mi baz mı? Asit ve bazlar nelerdir? Sirkeli su asit mi baz mı? CH3COOH asit mi baz mı? Asit baz bileşik formülleri nelerdir? HCl baz mı? Coca Cola asit mi baz mı? Mayonez mi baz mı? Limon suyu bazik mi? Gazoz mi baz mı? Diş Macunu asit mi baz mı? Meyveler baz mı? Turşu su asit mi baz mı? Göz yaşı baz mı? Akü suyu asit mi baz mı? Kabartma tozu baz mı? Saç yağı asit mi baz mı?
20 tane baz örneği
Sodyum hidroksit (NaOH): Sabun, lavabo açıcı. · Potasyum hidroksit (KOH): Arap sabunu, sıvı sabun, şampuan. · Kalsiyum hidroksit [Ca(OH)2]: Sıva ve harç.
KONU DIŞI Siyah nokta, akne, sivilce ve leke gibi cilt kusurlarını gizlemeye ve cilt yüzeyini düzleştirmeye yarayan makyaj bazlarına primer adı da verilir. Makyaj bazı ne işe yarar? sorusunun cevabı ise makyaj bazı, makyajın cilt ile bütünleşmesini ve kalıcı olmasını sağlar.
-
Şampuan baz mı?
Asit
-
Baz nedir özellikleri nelerdir?
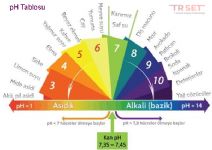
Asit mi baz mı? Baz nasıl oluşur?Baz suda iyonlaştıklarında hidroksit iyonu derişimini arttıran maddeler yani suda iyonlaştıklarında ortama OH⁻ iyonu ve elektron çifti verebilen maddelere verilen isimdir. PH seviyeleri 7'nin üzerindeki maddelerdir. Bazlar da, asitler gibi tehlikeli maddelerdir. Tatları acıdır. Turnusol temas edince mavi renge döner.
-
Baz olduğunu formülden nasıl anlarız?
Baz nasıl anlarız? Hangi maddeler bazdır? Formüle bakarak baz olduğunu anlama.Turnusol kağıdı mavi renge döner. PH seviyesi 7 üzerindedir. Acı tatları vardır.
EĞER formülde H- iyonu fazla ise bazdır. CH₃COOH haricinde kalan tüm formüllerde H başta ise asit, H sonda ise bazdır.
-
Maden suyu asit mi baz mı?
Baz.
Ambalajlı gıdaların genelinde PH değeri yazmaktadır. PH skalasından nötr, asit ya da baz olduğunu anlayabilirsiniz.
-
Süt asit mi baz mı?
Asit
-
Yağ çözücü asit mi baz mı?
Asit
-
Yoğurt asit mi baz mı?
Asit









 Bu Sayfayı Paylaş
Bu Sayfayı Paylaş WhatsApp CH
WhatsApp CH Twitter
Twitter YouTube
YouTube Linked in
Linked in Instagram
Instagram Facebook
Facebook Türkçe
Türkçe Deutsch
Deutsch English
English