- TRSET
Asitler hangileridir? Asit ve turnusol kağıdı etkileşimi.
Turnusol kağıdı ne renk olur? Asitlerin tam listesi.
Asitler nasıl anlaşılır? Asitler sıvı mıdır? Asit olanlar ve olmayanlar
+ index service
+ TR Search Engine Technology
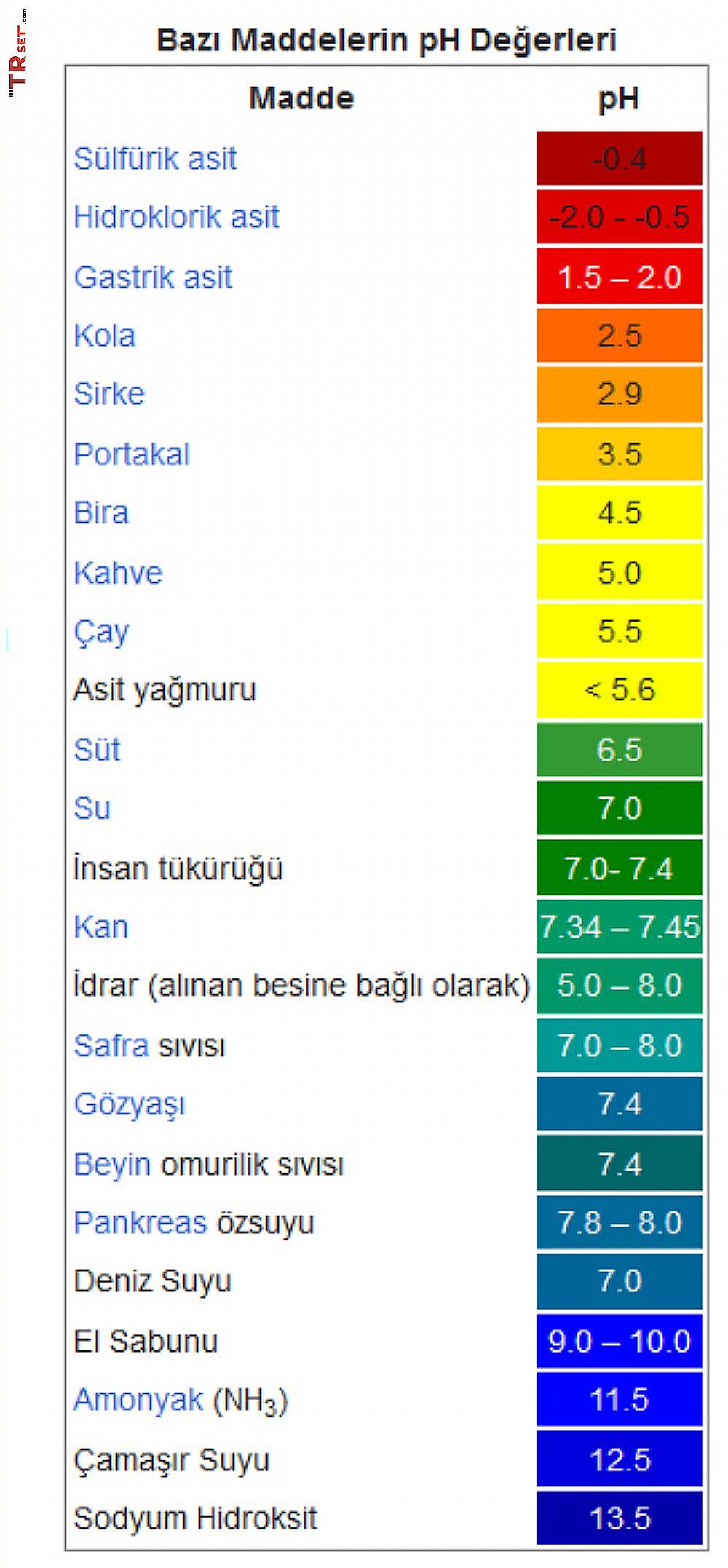
Asit pH derecesi 7 'den düşük, değişen oranlarda yakıcı - aşındırıcı özellikte ve oldukça geniş kullanım alanına sahip kimyasal maddelere verilen isimdir. Suda çözündüklerinde hidrojen iyonu derişimini artırarak çözeltiyi asidik yapar.
Asitler kimyada önemli bir bileşik sınıfını oluşturur. Gıda maddelerinin bir çoğunda asit vardır ve bu nedenle canlıların yaşamsal faaliyetlerinde asitlerin önemi büyüktür. Mide özsuyu besinlerin sindirimi için %0,4 (binde dört) oranında HCl içerir. Proteinler ise amino asitlerden oluşur. Asitler inorganik ve organik olabilirler. Yapısında karbon bulunmayan asitlere inorganik asitler, karbon elementi kullanılarak oluşturulan asitlere de organik asitler denir.
Asit Latincede ekşi anlamına gelir. Ekşi tat veren maddeler asit özelliğine sahiptir. Limonda sitrik asit, elmada malik asit mevcuttur ve tüm asitler gibi sulu çözeltilerinde hidrojen (H+) iyonu bulunur.
HCl → H+ + Cl- ♦ HNO3 → H+ + NO-3 ♦ H2SO4 → 2H+ + SO4-2
Asit çözeltilerini başka sıvılardan ayırt etmek için turnusol kâğıdı kullanılabilir. Asitler, mavi turnusol kâğıdını kırmızıya çevirir.
Asitler suda çözünmelerinden dolayı iyonlarına ayrışır ve içinde iyon barındıran sıvı elektrik akımını iletir. Elektrik akımını ileten sıvılara elektrolit denir. Asitler metallerle tepkimeye girerek hidrojen gazı (H2) açığa çıkarırlar Asitler metallere aşındırıcı etki yaparlar ve bu özelliklerinden dolayı asitler metal kaplar içerisinde değil, cam ya da plâstik kaplarda saklanır.
Asitler bazlarla tepkimeye girerek tuz ve su oluşturur. Bu olaya nötrleşme tepkimesi denir, ekzotermik bir olaydır. Asit + Baz → Tuz + Su + Isı
Sulu çözeltilerde büyük oranda iyonlarına ayrışabilen asitlere kuvvetli asit denir. Zayıf asitlerin ise sadece bir kısmı suda iyonlarına ayrışır. Kuvvetli asitler çok tahriş edici ve yakıcıdır ve tahta, kağıt, kumaş, et gibi birçok maddeyi kısa sürede parçalayabilirler.
Hayatımızda Asitlerin Yeri
 Sirke, seyreltik bir asetik asit çözeltisidir. Araba akülerinde sülfürik asit kullanılır. Nitrik asit, boya ve gübre yapımında kullanılır. Temizlikte kullanılan tuz ruhu seyreltik hidroklorik asit çözeltisidir. Midemiz ise seyreltik hidroklorik asit salgılayarak besinleri parçalar ve mide asidinin fazlalaşması midede ülsere sebep olur.
Sirke, seyreltik bir asetik asit çözeltisidir. Araba akülerinde sülfürik asit kullanılır. Nitrik asit, boya ve gübre yapımında kullanılır. Temizlikte kullanılan tuz ruhu seyreltik hidroklorik asit çözeltisidir. Midemiz ise seyreltik hidroklorik asit salgılayarak besinleri parçalar ve mide asidinin fazlalaşması midede ülsere sebep olur.
Bazı maddelerin yapısında hidrojen bulunmadığı hâlde, hidrojen iyonu (H+) oluşumuna sebep oldukları için sulu çözeltileri asit özelliği gösterir. Mesela CO2 ve SO2 suda asit özelliği gösteren maddelerdir. Havadaki karbon dioksit ve kükürt dioksit gazları da yağmur damlalarında çözündüklerinde asit olarak yere düşer. Asit yağmurları bu şekilde oluşur.
🧪 Asitlerin kullanım alanları ile ilgili başlığımıza buradan ulaşabilirsiniz. 👈
Kuvvetli Asitler. Suda İyonlaşma Durumu
Polar kovalan moleküller ⇒ iyonlar
Kuvvetli elektrolitler ⇒ % 100 iyonlaşma, beden dokuları üzerinde güçlü yakıcı özelliğe sahiptir.
Ama canlıların midesi HCl’e karşı mukus ve mukozal tabaka ile korunmaktadır
H2O
HCl(l) ⇔ H+(su) + Cl-(su)
HNO3(l) ⇔ H+(su) + NO3- (su)
H2SO4(l) ⇔ 2H+(su) + SO42- (su)
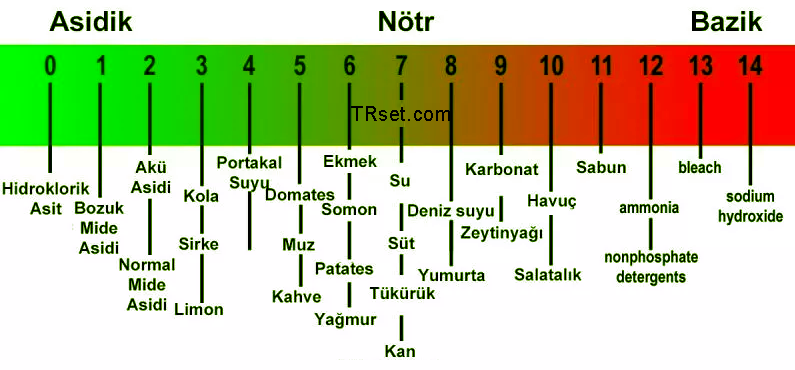
Zayıf Asitler
Doğada bir çok asit zayıftır.
CH3COOH Asetik Asit : sirke, jeller, plastikler, boyalar, insektisidler ...
H2CO3 Karbonik Asit : bikarbonat tampon sistem, karbonatlı içecekler ...
H3PO4 Fosforik Asit : ilaçlar, sabunlar, deterjanlar, hayvan yemleri vb
Zayıf elektrolitlere sahiptirler ve iyonlaşma % leri zayıftır. Polar kovalan moleküllerdir. Daha çok molekül olarak kalırlar
H2O
CH3COOH(l) ⇔ H+(su) + CH3COO-(su)
H2CO3(l) ⇔ H+(su) + HCO3-(su)
H3PO4(l) ⇔ H+(su) + H2PO4-(su)
Asitlerin Genel Özellikleri ve Asitleri Nasıl Anlarız?
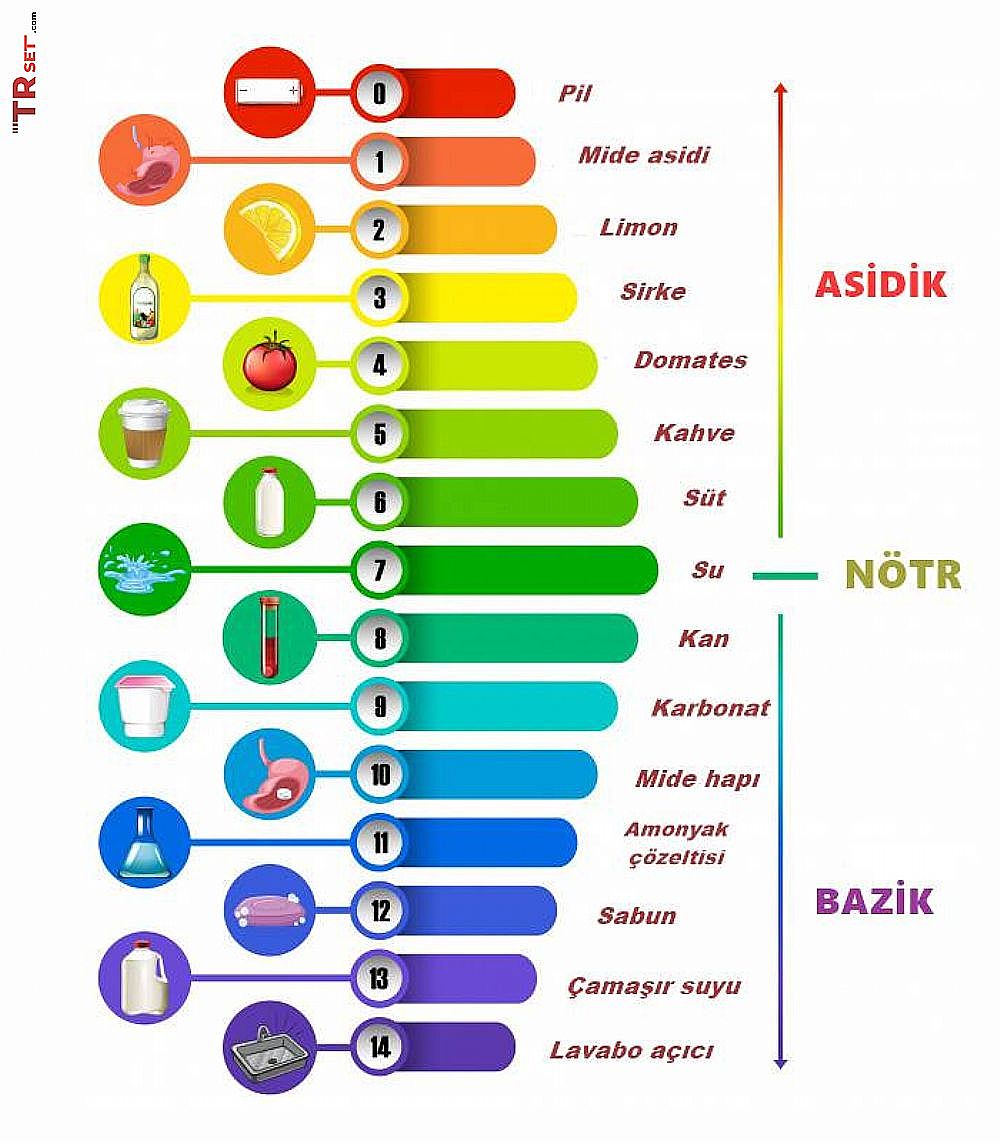 Tüm asitlerin tadları istisnasız olarak ekşidir. Sirkedeki asetik asit, ekşi elmada malik asit, limonda sitrik asit ve askorbik asit (Vit C), yoğurt suyunda laktik asit, meşrubat ve kolalarda karbonik asit bulunur.
Tüm asitlerin tadları istisnasız olarak ekşidir. Sirkedeki asetik asit, ekşi elmada malik asit, limonda sitrik asit ve askorbik asit (Vit C), yoğurt suyunda laktik asit, meşrubat ve kolalarda karbonik asit bulunur.
Ancak her asitin tadına bakılamaz. Çünkü asitlerden bazıları parçalayıcı bazıları da zehirlidir. Asitler yakıcı özelliğe sahiptir. Asitlerin bu özelliği her asitte aynı şekilde olmayabilir.
Mesela HNO3 deriye döküldüğünde proteinlerle tepkimeye girer. H2SO4 ise hücre suyunu çekerek yakma etkisi gösterir.
Asit suda çözüldüğünde ne kadar fazla iyon oluşuyorsa iletkenlik özelliği de o kadar fazladır. Bu nedenle kuvvetli asitlerde iletkenlik fazla, zayıf asitlerde ise azdır.
Asitler mavi turnusol kağıdını kırmızıya çevirir. Turnusol kağıtları indikatör boyası emdirilmiş kağıtlardır, daha detaylı bilgiyi TRset üzerinde bulabilirsiniz. İndikatör boyaları ortamın asidik veya bazik olmasına göre renk değiştiren maddelerdir.
Örneğin bir indikatör olan metil oranj, asit ortamda kırmızı renge döner.
Asitlerin genel olarak yapılarında proton bulunur. Ancak yapılarında hİdrojen bulunan tüm maddeler asit değildir. Yine aynı şekilde; HCl kuvvetli bir asit olmasına rağmen, NH3 baz özelliği gösterir. CH4 ise asit ve baz karakteri göstermez.
Bazlar ile birleşerek tuz ve su oluşturur. Kimyada bu tepkimelere nötrleşme tepkimesi denir.
Baz + Asit → Tuz + Su
NaOH + HCl → NaCl + H2O
2KOH + H2SO4 → K2SO4 + 2H2O
Ca(OH)2 + H2SO4 → CaSO4 + 2H2O
Asitler, metal oksitler (bazik oksitler) ile birleşerek tuzları yaparlar.
Metal Oksit + Asit → Tuz + Su
Na2O + 2HCI → 2NaCI + H2O
CaO + H2SO4 → CaSO4 + H2O
K2O + H2CO3 → K2CO3 + H2O
CuO + 2HNO3 → Cu(NO3)2 + H2O
Gıdalar açısından genelleme yapacak olursak; ACI BİBER hariç tüm meyve ve sebzeler asittir.
⇒ Bir maddenin ve/veya çözeltinin asit ya da baz olduğu formülden nasıl anlaşılır?
⇒ Bazlar hakkında teferruatlı bilgi ister misiniz?

-
Thermalbadanlage - Das Erbe des großen Führers Mustafa Kemal Atatürk
-
Dinamometre : Kuvvet Ölçer
-
Elektroskop
-
pH Dengesi, Asit, Baz ve Sulu Çözelti Dengeleri
-
Kimyasal Karışımlar. Karışım Nedir?
-
Mol nedir? Avogadro nedir? Herkes için anlaşılır kimya konuları.
-
Kimyada Bileşikler Nasıl Adlandırılır?
-
Le Chatelier Prensibi
-
Kovalent Bağ










 Bu Sayfayı Paylaş
Bu Sayfayı Paylaş WhatsApp CH
WhatsApp CH Twitter
Twitter YouTube
YouTube Linked in
Linked in Instagram
Instagram Facebook
Facebook Türkçe
Türkçe Deutsch
Deutsch English
English